fluorF's Laboratory
웹사이트 소개
Introduction of the website
fluorF 소개
Introduction of fluorF
새로운 소식
News
하루 이야기
Daily essay
글
Articles
사진첩
Album
방명록
Guestbook
글
Articles
미술 3
Fine Art 3
유화와 화학
기름 화학
Oil Chemistry
지난 편에서 유화의 전색제는 기름이라고 했다. 그런데 대관절 기름이 무엇인가? 아니 어떤 바보가 기름이 뭔지도 모르느냐고? 기름이 무엇인지 정의해달라고 누가 요청한다고 치자. 그렇다면 당신은 쉽게 그 질문에 대답할 수 있는가? 충격적이게도 쉽사리 대답할 수가 없는 독자 자신의 모습을 발견할 것이다. 그동안 우리는 기름의 성질이 어떠하다는 것에만 약간의 지식이 있을 따름이었다: 예를 들어 물에 잘 안 섞인다는 점, 끈적거린다는 점, 불에 잘 탄다는 점 따위 말이다. 사전도 다를바가 없는데, 국립국어원 표준대사전에 따르면 기름의 정의는 다름과 같다.
물보다 가볍고 불을 붙이면 잘 타는 액체. 약간 끈기가 있고 미끈미끈하며 물에 잘 풀리지 않는다. 동물의 살, 뼈, 가죽에 엉기어 있기도 하고 식물의 씨앗에서 짜내기도 하는데, 원료에 따라서 빛깔과 성질이 다르고 쓰임새가 매우 다양하다.
이런 식의 성질을 통한 정의는 영어 사전에서도 동일하게 확인할 수 있다. 옥스포드 사전에서는 다음과 같이 정의되어 있다.
Any of various viscous liquids which are insoluble in water but soluble in organic solvents and are obtained from animals or plants (물에는 녹지 않으나 유기 용매에 녹는 점성의 액체이며 동식물로부터 얻는다.)
하지만 이런 식의 부정확한 정의에 만족할 만한 과학자들이 아니다. 화학자들은 통상적으로 '기름'이라고 불리는 것이 대관절 어떤 구조를 가진 화학 물질인지 파악하기 위해 수많은 분석을 진행했고, 그 결과 기름에 대한 정의를 다음과 같이 내릴 수 있었다.
비극성의 탄소 화합물로서 상온에서 액체인 트라이글리세라이드(triglyceride)
무슨 알 수 없는 말들만 나온다. 우선, 트라이글리세라이드란 무엇인가? 트라이글리세라이드는 세 개의 수산화기(hydroxy group, -OH)를 가진 3가 알코올인 글리세롤(glycerol)이 세 개의 지방산(fatty acid)과 에스터(ester, -COO-) 결합을 하여 만들어진 물질을 말한다. 그럼 지방산은 무엇인데? 지방산은 카복실산(carboxylic acid)의 일종으로 카복실기(carboxyl group, -COOH)가 굉장히 긴 탄소 사슬 끝에 달려 있는 물질을 말한다. 이 긴 탄소 사슬을 통칭하여 알킬(alkyl) 그룹이라고 하는데 기름의 종류는 바로 이 알킬 그룹이 어떻게 생겼느냐에 달려 있다. 즉 모든 기름들은 트라이글리세라이드라는 구조를 동일하게 갖고 있으되 구성 알킬 그룹의 종류가 다를 뿐이라는 것이다. 어떤 예가 있을까 ㅡ 똑같이 네 명으로 구성된 재즈 쿼텟(quartet)이더라도 어떤 쿼텟은 피아노, 색소폰, 베이스, 드럼으로 구성되어 있지만 다른 쿼텟은 피아노, 기타, 베이스, 드럼으로 구성될 수도 있다. 즉 쿼텟이라는 밴드 형태만 같을 뿐 구성 요소는 쿼텟마다 다르며 따라서 다양한 종류의 재즈 밴드가 탄생할 수 있는 것이다.
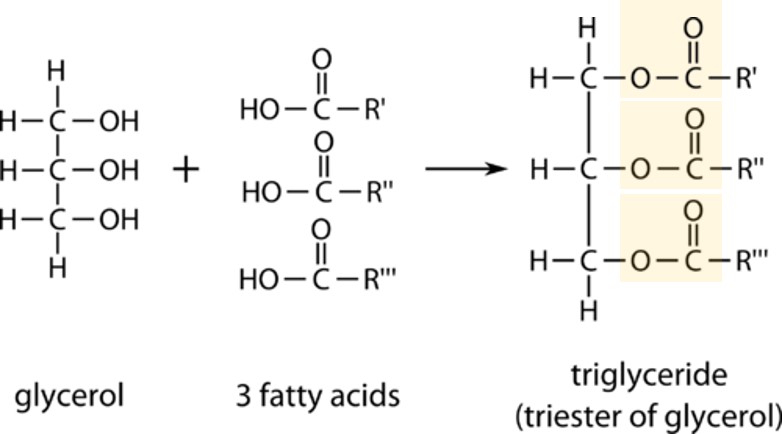
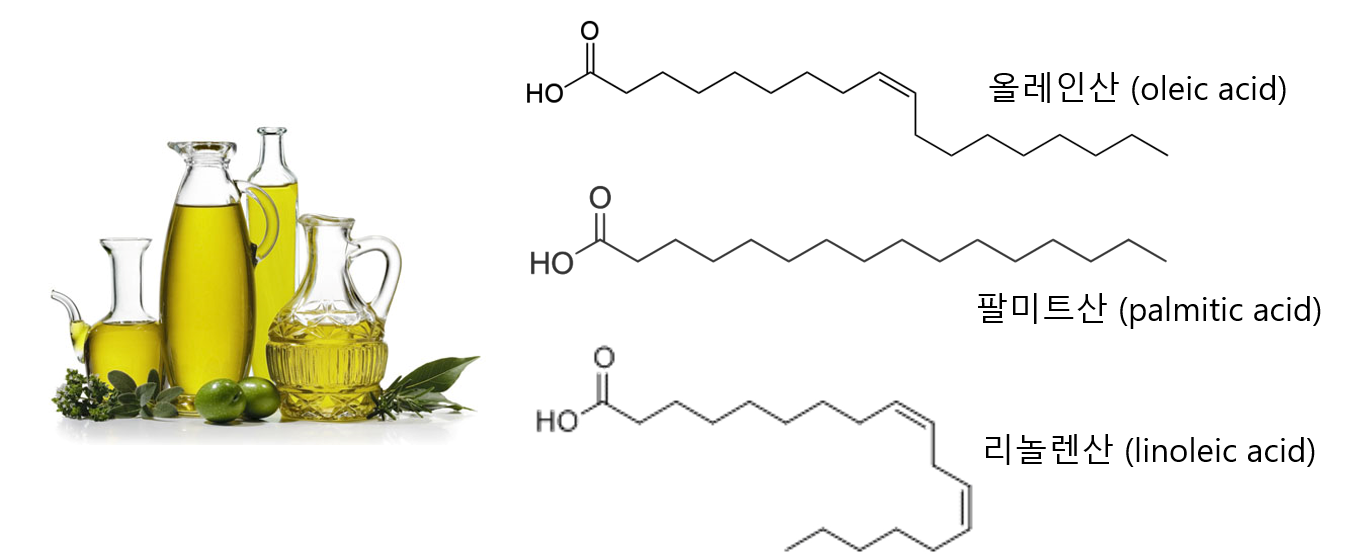
예를 들어 올리브유(olive oil)을 살펴보자. 올리브유를 구성하는 주된 지방산은 올레인산(oleic acid, 55-83%), 리놀렌산(linoleic acid, 3.5-21%), 그리고 팔미트산(palmitic acid, 7.5-20%)이다. 화학 구조를 살펴보면 팔미트산은 단선으로만 구성되어 있는데, 올레인산에는 이중선이 하나, 그리고 리놀렌산에는 두 개가 있는 것을 알 수 있다. 유기화학에서 이렇게 단선으로 그려진 것은 탄소 원자 사이의 결합이 단일 결합이라는 뜻이며, 이중선으로 그려진 것은 이중 결합이 있다는 것을 의미한다. 단일 결합과 이중 결합에 대한 화학적인 설명은 다음 장에서 진행할테니 궁금하더라도 일단 넘어가자. 일단 단선은 단일 결합, 이중선은 이중 결합이라고만 이해하자. 이에 따르면 팔미트산은 단일 결합으로만 구성된 지방산인 반면 올레인산과 리놀렌산은 이중 결합이 포함되어 있는 지방산이다.
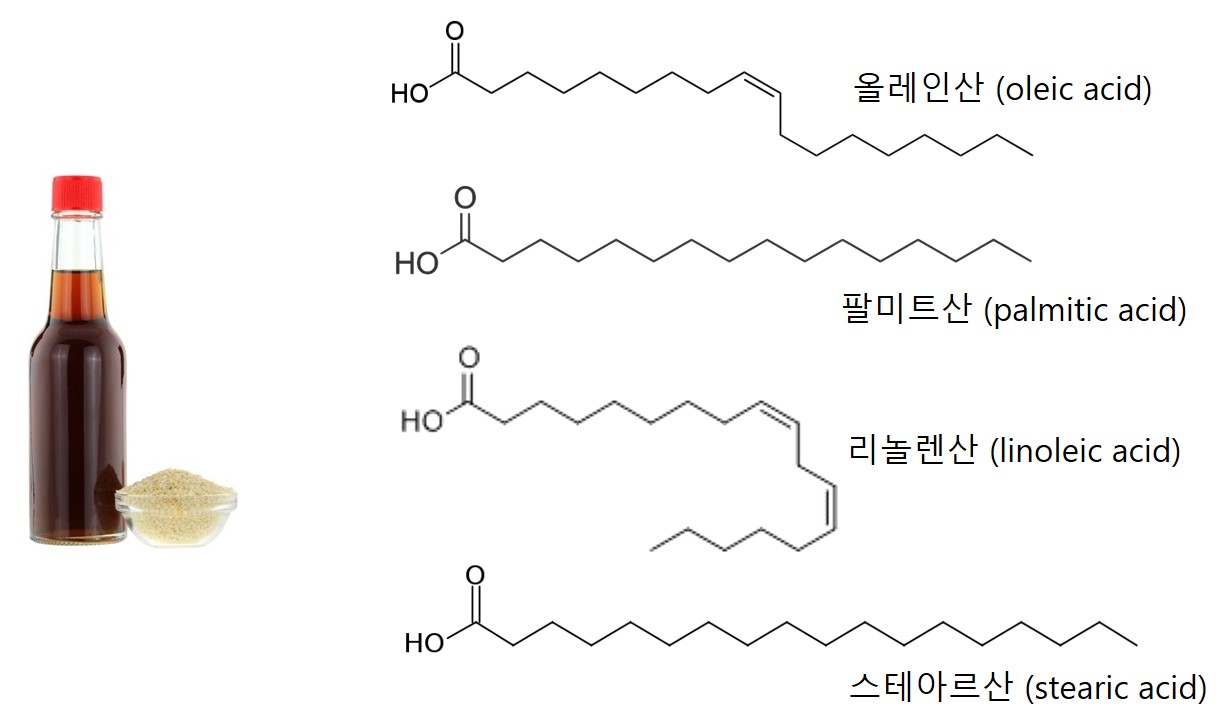
고소한 참기름(sesame oil)은 어떨까> 참기름의 구성성분은 올리브유와 크게 다르지 않으나 알킬 그룹의 길이가 좀 더 긴 스테아르산(stearic acid, 5%)가 보인다. 또한 올리브유와는 달리 올레인산의 함량(~39%)이 리놀렌산의 함량(~41%)보다 적은데, 이것은 참기름 분자 내의 이중 결합 개수가 올리브유 분자 내의 이중 결합 개수보다 많다는 것을 의미한다.
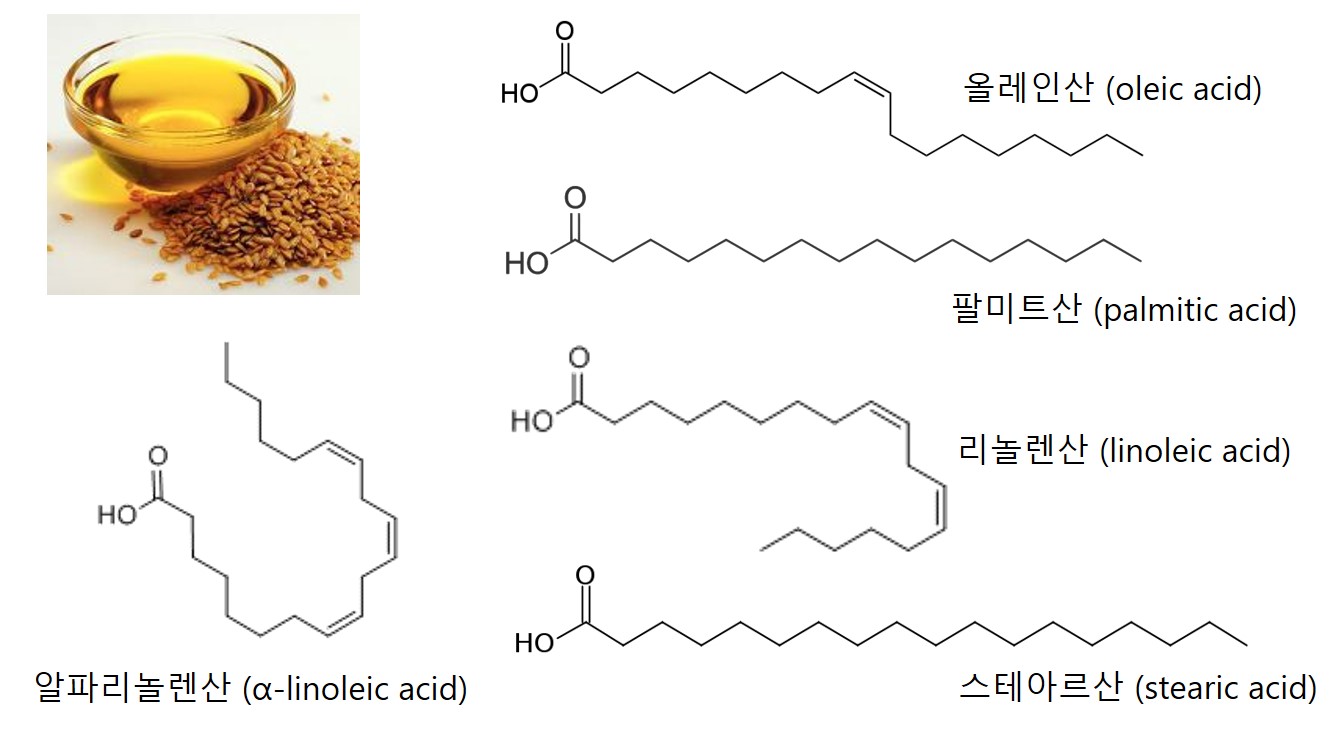
이제 우리가 관심을 가지고 있는 아마인유(亞麻仁油, linseed oil)을 살펴보자. 아마인유는 참기름의 구성성분에 더해 알파리놀렌산(α-linoleic acid)이 높은 함량(~41%)으로 존재하는데 이 알파리놀렌산은 이중 결합이 3개나 있는 지방산이다. 따라서 아마인유는 올리브유나 참기름보다도 더 많은 수의 이중 결합을 가지고 있다.
조금 더 하드코어한 화학 이야기를 해보자. 지방산 구조에서 도대체 단일 결합은 무엇이고 또 이중 결합은 무엇인가? 단일 결합과 이중 결합에 대해 이해하려면 탄소라는 원자가 다른 원자들과 어떻게 결합하는지를 먼저 이해해야 한다. 참고로 처음에 이 페이지를 처음 만들 때에는 루이스 점 전자식부터 시작해서 공유 결합에 대해서 구구절절이 설명하려고 노력했는데, 그런 설명 자체가 너무나도 거대한 군더더기라는 것을 발견했기에 자세한 내용은 생략하기로 했다. 그렇다면 어디서부터 시작해야 할까?
원자간 결합의 기본은 원자의 구성 요소 중 하나인 전자(電子, electron)이다. 모든 원자는 원자번호에 해당하는 개수만큼의 양성자(陽性子, proton)과 전자를 가지고 있는데, 양성자들이 원자의 중심에 아주 작은 핵의 형태로 밀집되어 있는데 반해 전자들은 원자핵 주변에 존재하고 있다.1 그런데 전자들이 아무렇게나 존재하는 것은 아니며, 존재할 수 있는 특별한 상태들은 소위 파동 함수(wave function)라는 것으로 정의되어 있다. 그리고 그 파동 함수는 에르빈 슈뢰딩거(Erwin Scröt;dinger)가 정립한 파동 방정식의 해(解, solution)에 해당하는데 이를 우리는 오비탈(orbital)이라고 부르며, 각 오비탈은 최대 2개의 전자의 존재를 나타낼 수 있다.2 이 복잡한 것을 다 기억할 필요는 없고, 결합에 관여하는 탄소 원자의 오비탈은 2s 1개와 2p 3개, 즉 기본적으로 네 개가 있다는 것을 먼저 받아들이자.
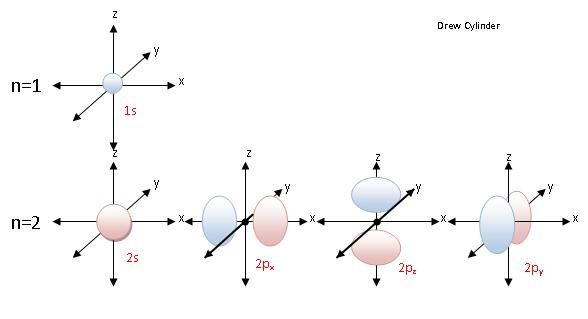
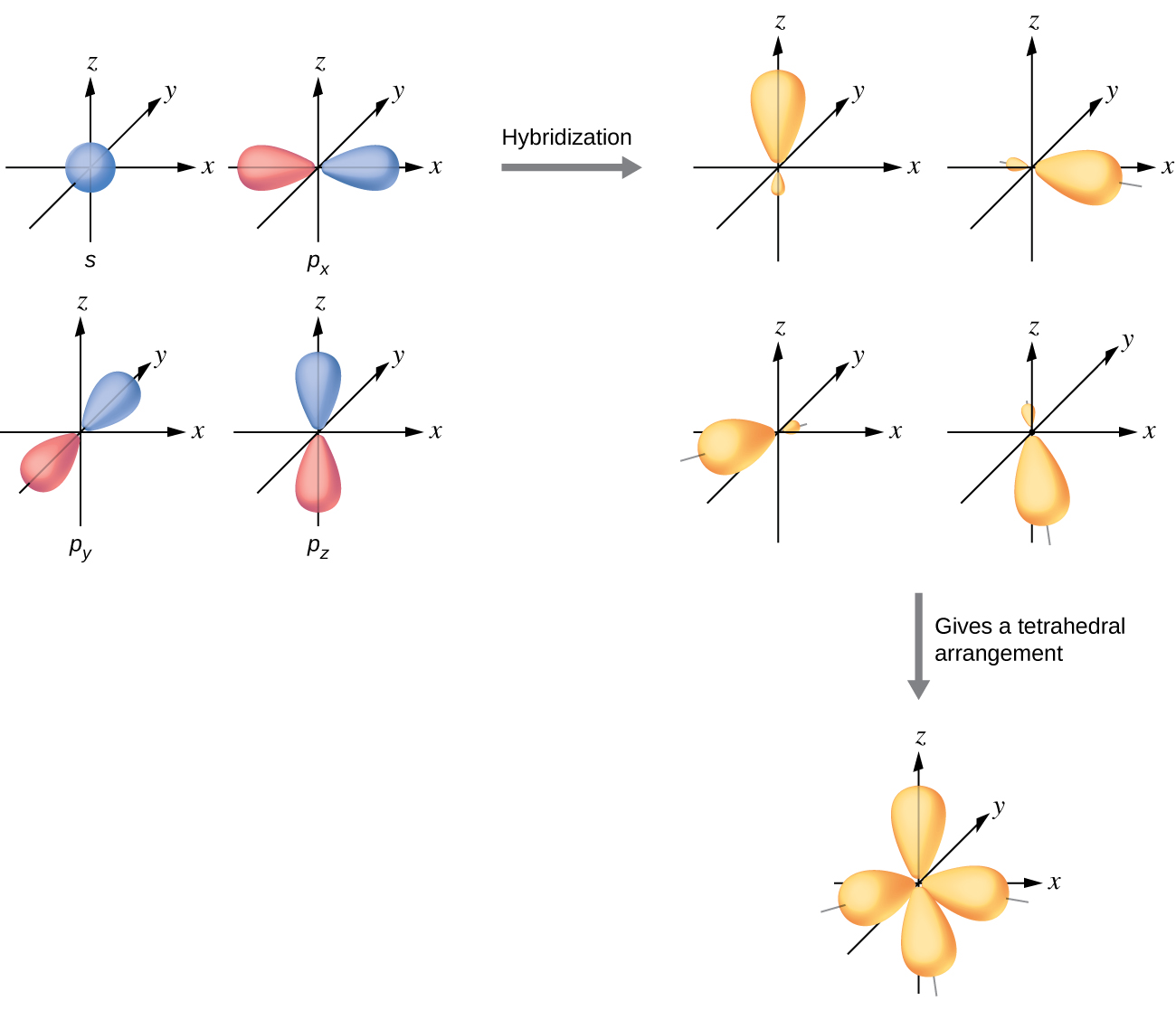
이들 오비탈은 슈뢰딩거 방정식을 만족시키는 해인데, 2s 오비탈과 2p 오비탈에 적당한 숫자를 곱한 다음에 더해줘서 만든 새로운 함수, 즉 오비탈들의 선형 결합 역시 슈뢰딩거 방정식을 만족시킨다.3 이런 원리로 만들어질 수 있는 것이 소위 혼성 오비탈(hybrid orbital)이라는 것이다. 가장 기본적인 혼성 오비탈은 2s 1개와 2p 3개가 3차원적으로 모두 뭉쳐져서 만들어지는 것이다. 찰흙 놀이를 한다고 생각해보는 것이다. 2s 오비탈은 둥그런 형태이고 2p 오비탈은 아령같이 생겼는데, 이들을 한데 모두 섞어서 뭉치면 평범한 공이 만들어진다. 자, 이것을 이제 똑같이 4개로 나누면 정사면체의 꼭지점을 향하는 형태의 새로운 형태의 비대칭 아령들이 만들어진다. 이 비대칭 아령을 sp3 라고 부른다.
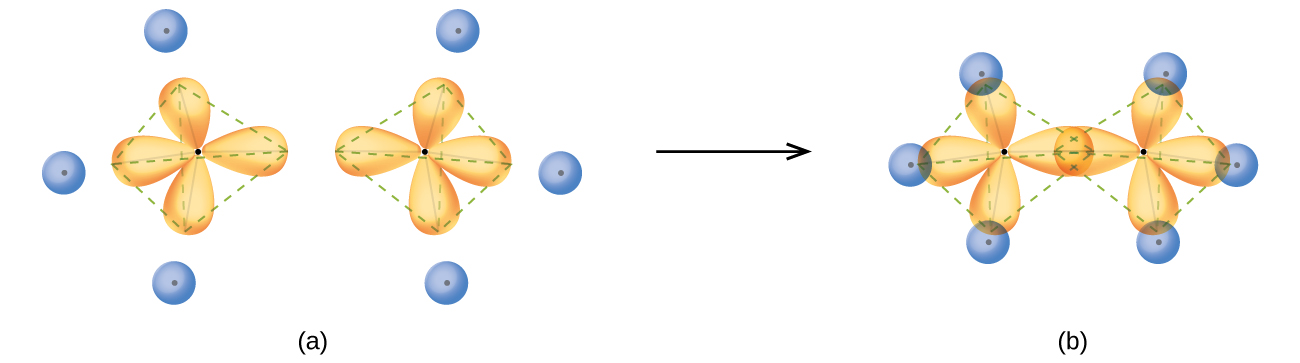
이렇게 생긴 탄소의 정사면체 아령들끼리 직접적으로 맞닿게 되면 두 탄소 원자 사이에 σ 분자 오비탈이 형성되면서 결합이 이뤄지게 되는데 이는 화학 구조식에서 단일선(ㅡ)으로 간략화되어 표기되며 이를 단일 결합이라고 부른다.
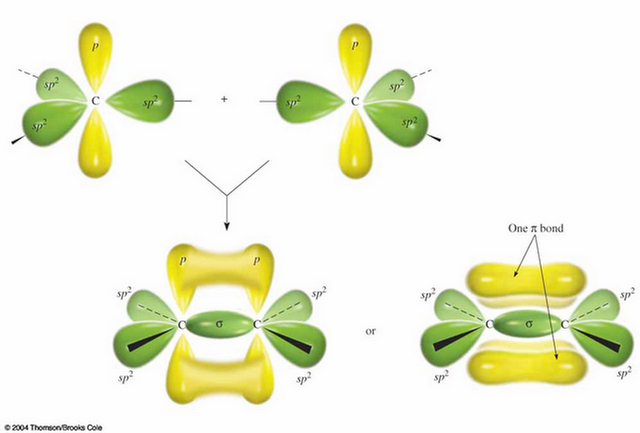
한편 2s 오비탈 하나와 2p 오비탈 2개만 뭉쳐져서 혼성 오비탈을 만들 수 있다. 이렇게 만들어진 sp2 오비탈은 평면상에 삼각형 꼭지점을 향하는 형태를 취하게 되고, 혼성화에 참여하지 않은 2p 오비탈 하나만 수직한 방향으로 꼿꼿이 제 모습을 유지한 채 존재하게 된다. 이렇게 생긴 탄소의 삼각형 아령들끼리 직접적으로 맞닿게 되면 두 탄소 원자 사이에 σ 분자 오비탈이 형성되면서 결합이 이뤄지게 된다. 그런데 이 경우 수직하게 세워져 있던 2p 오비탈들이 간접적으로 느슨하게 겹쳐지게 된다. 이렇게 형성되는 결합 오비탈을 π 분자 오비탈이라고 부르며 화학 구조식에서 이중선(=)으로 표기되는데 이것이 바로 이중 결합이다. 즉, 탄소간 이중 결합은 단일 결합이 두 개 겹쳐져 있는 것이 아니고 동일한 σ 결합에 더하여 π 결합이 추가되어 있는 것이다. 재미있게도 ― 화학을 싫어하는 사람에게는 결코 재미있을 수 없는 사실이긴 하지만 ― 이 π 결합 오비탈 안에 들어 있는 전자는 σ 결합 오비탈 안에 있는 전자보다 에너지 측면에서는 더 불안정하기 때문에 전자를 뺏어갈 수 있는 물질5이 접근하는 경우 π 결합 오비탈 안에 들어 있는 전자를 쉽게 취하면서 탄소 원자와 σ 결합을 형성하여 그냥 붙어버리게 된다.
이러한 메커니즘으로 표현되는 대표적인 반응이 이른바 할로젠 첨가 반응(halogen addition reaction)이라고 불리는 반응이다. 할로젠이란 원소 주기율표상 17족에 해당하는 원소들로 플루오린(F), 염소(Cl), 브로민(Br), 아이오딘(I), 그리고 지구상에 극소량 존재하는 아스타틴(At)과 최근 국제 순수 및 응용 화학회(Internatioal Union of Pure and Applied Chemistry, IUPAC)에서 발견이 인정된 테네신(Ts)이 할로젠 가족의 일원이다. 예를 들어 이중결합을 가진 어떤 분자가 있다고 상상을 해보자. 여기에 브로민(Br2)을 넣고 반응을 보내면 브로민의 두 원자는 이중결합을 이루고 있던 두 탄소 원자에 각각 하나씩 달라붙게 된다. 브로민 입장에서는 이중 결합에 '첨가'되는 것이므로 이를 할로젠 참가 반응이라고 부른다. 물론 탄소 입장에서는 이중 결합이 단일 결합으로 '깨지는' 것이 된다.
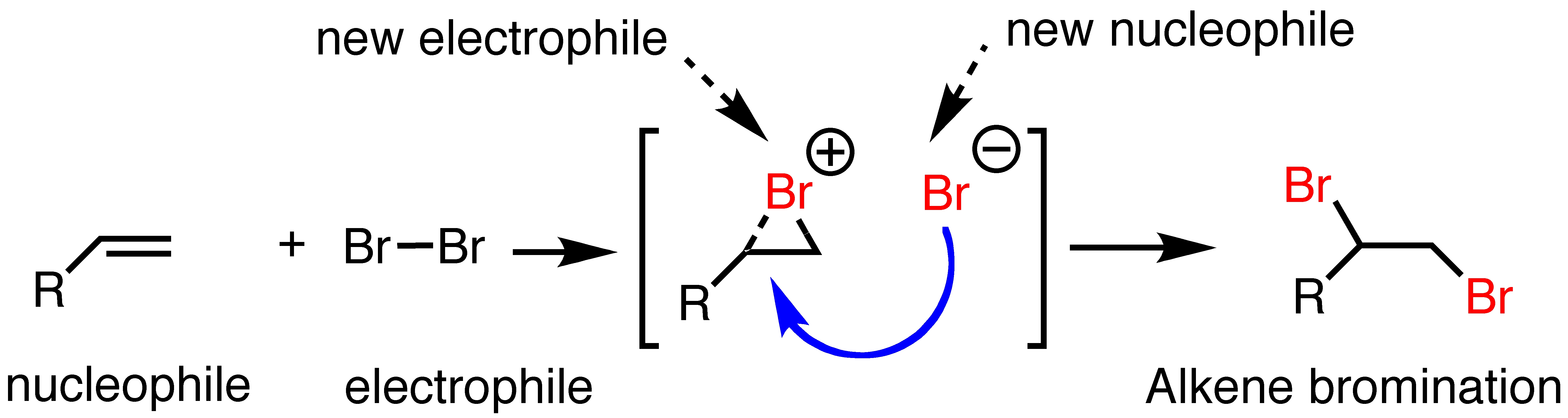
이해할 수 없는 화학 이야기를 다 집어치우더라도 이것 하나만 기억하면 된다: 이중 결합을 가지고 있는 물질에 할로젠을 첨가하게 되면 얘네들이 첨가되면서 탄소의 이중 결합이 깨지게 된다. 사람들은 바로 이 특성을 이용해서 기름의 특성을 나타내는 척도 하나를 만들어내는데 이름도 범상치 않는 아이오딘값(요오드값)이다.6 만일 탄소간 단일 결합으로만 구성된 기름 100 g 이 있다고 치자. 여기에 아이오딘 고체를 과량(過量)으로 퐁당 떨어뜨리고 반응을 시켰다. 문제는 탄소간 단일 결합은 아이오딘과 굉장히 뻘쭘한 관계라서 아무런 반응도 진행하지 않는다. 소개팅은 실패했고 결국 기름에 넣었던 아이오딘 고체는 그 질량 그대로 다시 회수될테니 기름의 질량은 여전히 100 g 이 될 것이다. 이 때 아이오딘값은 0이 된다.
이번에는 이중 결합을 가지고 있는 올리브유 100 g 에다가 아이오딘을 넣었다. 올리브유에는 이중 결합이 있기 때문에 넣어준 아이오딘 중 일부는 올리브유에 첨가될 것이다. 즉 소개팅 일부 성공이다! 반응을 하지 않고 남은 아이오딘을 다 제거하고나서 기름의 질량을 재면 당연히 기름의 질량은 첨가된 아이오딘의 양만큼 증가되었을 것인데 실제로 측정해보니 그게 한 184 g 정도 되었다더라. 이 때 올리브유의 아이오딘값은 84가 된다. 다시 말해, 100 g의 기름에 첨가되는 아이오딘의 질량을 g 수로 나타낸 것이 아이오딘값의 정의가 되겠다.
아이오딘값이 높다는 것은 기름에 첨가되는 아이오딘의 양이 많다는 것인데 그러기 위해서는 기름에 이중 결합의 수가 많아야 한다. 즉, 기름 분자 구조 내의 이중 결합 개수와 아이오딘값은 비례 관계에 있다. 기름마다 이중 결합 개수는 제각각이기 때문에 아이오딘값도 다양한데 아래 표에서 이를 나타내었다.
| 기름 종류 | 아이오딘값 |
|---|---|
| 코코넛유 | 7~12 |
| 팜유 | 44~51 |
| 올리브유 | 80~88 |
| 참기름 | 103~116 |
| 콩기름 | 120~136 |
| 아마인유 | 136~178 |
| 동유 | 163~173 |
과학으로 세상 꼬집기 1편의 '소이캔들이 건강에 좋다고?' 편에서도 설명한 바 있지만, 통상적으로 이중 결합이 많이 포함된 지방을 불포화 지방(unsaturated fat)이라고 부르곤 하는데 탄소간 이중 결합이나 삼중 결합의 경우 첨가 반응을 일으킬 수 있으므로 아이오딘과 같은 다른 물질이 충분히 첨가될 만큼 결합이 '포화되지 않았음'을 의미하는 단어라고 생각해도 좋다. 그런데 회화 쪽에서는 약간 다른 분류 명칭을 사용한다. 이중 결합이 많이 포함된, 아이오딘값이 높은 기름을 건성유(乾性油, drying oil)이라고 부르며 반대로 이중 결합이 적게 포함된, 아이오딘값이 낮은 기름을 불건성유(不乾性油, nondrying oil)이라고 부른다. 이 체계에 따르면 코코넛유와 팜유는 불건성유에 포함되고 아마인유와 동유는 건성유에 포함된다. 콩기름 정도면 반건성유(半乾性油, semidrying oil)라고 할 수 있겠다.
건성유의 건(乾)은 '마르다'를 의미하는 한자니까 건성유라는 단어는 '마르는 기름'을 뜻한다. 가만 있자, 기름이 마른다고?
화학자의 상식에 비추어볼 때, 기름이 마른다는 말은 굉장히 이상한 말이다. 마르는 현상은 곧 증발(蒸發, evaporation)인데 증발은 액체 표면의 분자가 끓는점 아래에서 기체 분자로 기화(氣化, vaporization)하는 현상을 일컫는다. 따라서 기름이 마른다고 하는 것은 기름 표면의 기름 액체 분자가 상온에서 기름 기체 분자로 기화한다는 것을 의미한다. 문제는 상온에서 기름이 기화되는 현상은 일어나기 굉장히 어려운 현상이라는 것이다. 이유는 비교적 간단하다. 기름은 세 개의 긴 탄소사슬로 구성된 거대한 분자인데, 기름 분자들 사이의 상호작용은 분자량의 크기가 커질수록 대체로 증가하는 판데르발스 힘(Van der Waals force)이므로 결과적으로는 기름 분자 사이의 상호 작용은 상당히 강한 편이다. 이를 좀 더 유식하게 표현하면 기름의 증기압(蒸氣壓, vapor pressure)이 굉장히 낮다고 할 수 있는데, 그 결과 기름의 끓는점은 매우 높게 된다. 실험실에서 100도 이하의 온도로 중탕(重湯, double boiling)할 때에는 물을 사용하지만 100도 이상 200도 이하의 온도로 끓일 때에는 기름을 사용하는 이유가 여기에 있다. 심지어 어떤 기름들은 애초에 끓는점에 도달하기 전에 이미 그을음 연기를 내며 타기 시작한다. 즉, 분자량이 큰 기름 분자들 사이의 상호 작용은 생각보다 강하므로 기름 분자가 상온에서 기화하는 현상이 일어날 확률은 매우 낮다는 것이 과학적인 고찰 결과가 될 것이다.
하지만 화학자들과는 달리 유화를 그리는 화가들에게 기름이 마른다는 표현은 매우 익숙한 것이다. 이전 편에서 수채화 물감은 물이 전색제(展色劑, vehicle)이고 유화 물감은 기름이 전색제라고 했다. 이 전색제의 차이는 물감이 평면 위에 고착(固着), 즉 굳어 달라붙는 현상에 지대한 영향을 주게 된다. 도화지에 칠하면 금방 종이에 흡수된 뒤 수 분 내에 물이 증발하면서 고착되는 수채화 물감과는 달리 유화 물감의 경우 캔버스에 칠한 뒤 며칠 동안은 그대로 놔 두어야 캔버스 위에 완전히 고착된다. 바로 이 현상, 즉 물감이 고착되는 현상을 화가들은 '물감이 마른다'라고 표현해 왔다. 옛날 사람들은 정말 기름이 물처럼 기화하게 되면서 물감만 오롯이 캔버스 위에 달라붙는다고 생각해서 물감이 마른다고 표현하는 데 어색함을 느끼지 않았을는지도 모르겠다. 하지만 그가 현대 화학자를 친구로 두었더라면 결코 물감이 마른다는 비과학적인 용어를 쓰지는 않았을 것이다. 그렇다면 유화 물감, 아니 정확히 말해서 유화 물감의 전색제인 기름이 마른다는 것은 화학적으로 어떻게 이해될 수 있는 것인가?
기름이 마르는 현상에 대해서는 요리를 하는 사람도 화가들처럼 경험한 바가 있을 것이다. 요리를 위해 쓰이는 기름들의 경우 대체로 플라스틱 병에 잘 밀봉되어 있으므로 오랫동안 액체 상태를 유지한 채로 요리에 사용될 수 있다. 하지만 요리를 하다가 바닥이나 요리 기구에 튀거나 묻은 기름의 경우 오랜 시간이 지날 때까지 제 때 닦이지 않았다면 더 이상 액체라고 부르기에는 조금 민망한 찐득찐득한 반고체(半固體)가 되어 있는 것을 경험한 적이 있을 것이다. 즉, 기름은 공기 중에 오랫동안 노출되면 점도가 상당히 높아지게 되면서 어느새 고체가 된다. 뭔가 느낌이 오지 않는가? 캔버스에 칠한 기름이든 요리하다가 튄 기름이든 기름이 마르는 데 기여하는 원흉은 바로 공기 중 산소이다.
공기 중의 산소 분자(O2)는 기름 분자의 이중 결합에 느슨하게 첨가되면서 불안정한 과수산화기(hydroperoxide group, -OOH)을 형성한다. 불안정하다는 것은 이 결합이 그다지 환영할만한 반응이 아니라는 것이며 이런 반응들은 굉장히 확률도 낮고 속도도 느리다. 그런데 가뭄에 콩나듯이 이렇게 형성된 과수산화기는 운이 좋은 경우 인접한 기름의 이중 결합에 재차 첨가될 수 있다. 그러면 물 분자가 빠져 나오면서 두 기름 분자 사이에는 새로운 화학 결합이 형성되는데 산소 원자 하나로 연결된 탄소 원자간 결합을 유기화학에서는 이써(ether, -O-) 결합이라고 한다. 그 결과 서로 다른 분자였던 두 기름 분자는 이써 결합을 통해 연결이 되고 분자량은 갑절이 된다. 그런데 이 반응이 며칠동안 천천히 진행된다고 생각해보자. 처음에는 하나와 하나가 결합에서 두 개가 될 뿐이지만 두 개짜리가 서로 또 결합하게 되면 네 개짜리가 되고, 네 개와 네 개가 결합하면 여덟 개짜리가... 결국 시간이 지날수록 이써 결합이 형성되면서 기름 분자의 분자량은 기하급수적으로 급증하게 된다.
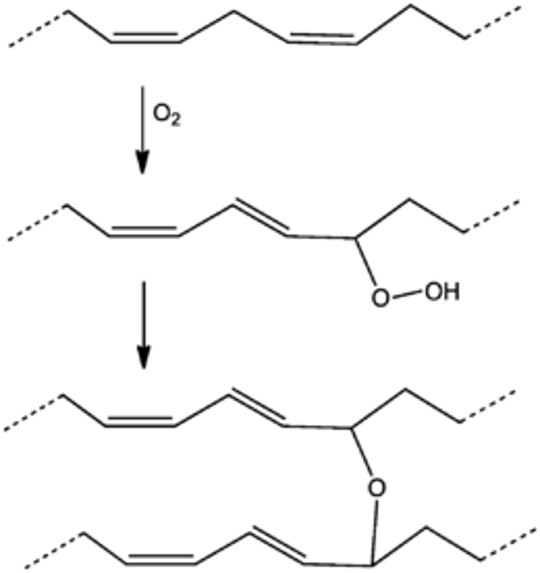
앞에서 기름 분자의 상호 작용이 높은 이유는 분자량이 높아서라고 그랬다. 그런데 그랬던 기름 분자의 분자량이 이제는 무한대에 가까워질 정도로 엄청나게 커지므로 분자의 상호작용 역시 엄청나게 높아지게 된다. 여기서부터는 기름이 트라이글리세라이드라는 하나의 단일 분자가 아닌, 이써 결합으로 길게 연결된 하나의 거대 분자(macromolecule), 즉 고분자(高分子, polymer)로 취급될 수 있다. 이 경우, 이써 결합과 같이 서로 다른 단일 분자들을 연결시켜 거대한 분자량을 가진 네트워크 형태의 고분자로 만들어주는 결합의 형성을 고분자화학에서는 가교(架橋, cross-link)라고 표현하는데 과연 '다리를 놓는다'는 표현이 적절하게 잘 들어맞는 표현이 아니라 할 수 없다. 즉 기름이 마르는 현상은 사실 산소 분자에 의한 기름 분자의 가교 현상이었던 것이다.
기름이 거대한 고분자가 되면서부터는 더 이상 끓는점이나 어는점이라는 말이 의미가 없게 되어버린다. 대신 고분자들은 분자량이 작은 저분자(低分子)와는 달리 유리전이온도(琉璃轉移溫度, glass transition temperature)라는 게 있다. 유리전이는 아직도 많은 과학자들이 정확하게 정의하기 어려워하는 다소 까다로운 현상으로, 흐물흐물하던 액체 상태의 물질이 특정 온도 이하에서는 유리와 같이 딱딱하고 깨질 수 있는 상태로 전이하게 되는데 이 온도를 유리전이온도라고 부른다.7 이는 물질을 구성하는 고분자가 비교적 자유롭게 병진 운동을 할 수 있게 되는 것에서 비롯된 것으로 이것은 저분자가 아닌 고분자만의 독특한 물성이라고 할 수 있겠다. 혹자는 이것이 어는점/녹는점과 다를 게 무엇이냐고 반문할 수 있겠지만, 어는점/녹는점은 고체-액체간의 전이이므로 고체의 정의가 '원자 혹은 분자들이 규칙적인 간격으로 배열된 상태'인 이상 결정구조의 형성 및 붕괴가 수반되어야 한다. 하지만 고분자의 경우 폴리에틸렌(polyethylene)과 같은 결정질 고분자(crystalline polymer)가 아닌 이상 대부분의 경우 비정질(amorphous)이기 때문에 온도를 낮추거나 높인다고 해서 결정구조의 형성 및 붕괴가 일어날 수 없다.
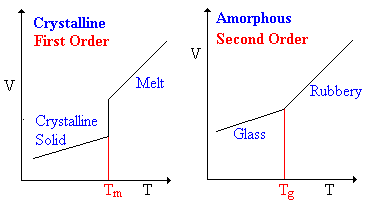
이 유리전이온도는 통상적으로 고분자의 분자량이 커질수록 높아진다. 몸집이 커지게 되면 외부 자극에 쉽사리 움직이지 못하게 되는 것과 같은 이치이다. 따라서 기름은 산소에 의해 가교가 진행될수록 분자량이 점점 커져 유리전이온도가 급상승하게 되고, 이것이 상온을 넘게 되는 순간 더이상 흐물흐물한 액체 상태가 아닌, 유리질(glassy) 상태로서 딱딱하게 굳은 액체 상태가 되는 것이다.9 이러한 유리전이가 일어나게 되면 기름의 물성은 고체의 그것과 거의 다를 것이 없게 된다.
회화 세계로 돌아가보자. 유화 물감이 캔버스 위에 칠해진다. 안료는 액체 기름이라는 전색제에 분산되어 있는 상태이다. 그런데 건조 과정을 거치면서 물감은 외부 공기와 끊임없이 상호 작용하게 되고 공기 중 산소 분자가 기름 분자들 사이에 이써 결합을 형성하면서 가교 반응을 이끈다. 그 결과 액체 기름의 분자량은 급증하여 유리전이온도가 상온 이상이 되어 버리고, 액체 기름에 분산되어 있던 안료는 딱딱하게 굳은 유리질에 그대로 갇히게 되어 캔버스 위에 영원이 고착된다. 이것이 바로 유화 물감이 '마르는' 화학 원리이다.
설명이 여기에 이르면 유화를 개척한 플랑드르(Flandre)의 화가들이 왜 아마인유를 유화 물감의 전색제로 사용했는지 이해할 수 있을 것이다. 물감의 성공적인 고착을 위해서는 기름 분자의 가교가 필수적이며 이를 위해서는 기름 분자에 이중 결합이 많이 포함되어 있어야 한다. 즉, 아이오딘값이 높은 기름을 써야만 한다. 수백년 전의 화가들이 아이오딘값 정보에 기반하여 어떤 기름을 유화 전색제로 사용할지 결정하지는 않았겠지만, 수많은 시행착오 끝에 아마인유가 유화에 적합한 기름이라는 사실을 경험적으로 알게 되었을 것이다.10 많은 예술인들은 경험적으로 아마인유를 사용해왔겠지만, 아마인유에는 이처럼 심오한 화학이 숨어 있었던 것이다.
- 1여기서 전자가 원자핵 주변을 돌아다닌다고 표현하지 않은 것에 유의하자. 백여년 전에는 전자들이 원자핵 주변을 마치 행성들이 태양 주변을 공전하듯이 원운동을 하며 돌아다닌다고 생각했었다. 하지만 양자 역학의 성립과 발전 이후에는 전자들이 원자 주변에 존재하되 전자가 존재할 확률은 파동 함수(wave function)의 제곱으로 표현된다는 보른(Born)의 해석을 따른다. 일반적인 상상과는 달리 전자들은 원자핵 주변을 공전하는 것이 아니다.
- 2전자의 스핀 양자수가 +1/2, -1/2로 두 개가 있기 때문에 흔히 하나의 오비탈에는 총 2개의 전자가 들어찰 수 있다고 표현한다.
- 3슈뢰딩거 방정식은 선형성(linearity)이 있는 방정식으로, 만일 특수해들이 존재한다면 이들의 선형 결합인 일반해 역시 방정식을 만족시킨다.
- 4https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chemistry_(OpenSTAX)/08%3A_Advanced_Theories_of_Covalent_Bonding/8.2%3A_Hybrid_Atomic_Orbitals, 이 페이지의 모든 혼성 오비탈 그림은 모두 이 사이트에서 가져왔다.
- 5유기화학에서는 이런 물질을 친전자체(親電子體, electrophile)라고 부른다.
- 6대중적으로는 '요오드'라는 이름이 아직 더 익숙하지만 대한화학회 화합물 명명법 규정에 따르면 '아이오딘'으로 개정된 지 오래다. 본 문서에서는 개정 규칙을 존중하여 아이오딘으로만 표현한다.
- 7유리전이온도 이상에서 흐물흐물하게 유연한 상태를 고무질(rubbery), 유리전이온도 이하에서 딱딱하고 깨질 수 있는 상태를 유리질(glassy)이라고 표현한다.
- 8https://faculty.uscupstate.edu/llever/polymer%20resources/glasstrans.htm
- 9유리전이온도에 익숙하지 않은 사람들에게는 굉장히 난해한 표현일 수 있겠다. 딱딱하게 굳었으면 고체이지 어째서 액체란 말인가? 하지만, 과학에서 통용하는 개념인 '고체(固體, solid)'라는 물질 상태는 원자나 분자가 규칙적인 결정 구조를 이루고 있는 상태를 말하는 것이라는 것을 기억하도록 하자. 규칙적인 구조가 아닌 경우 이를 비정질 고체라고 굳이 표현할 수는 있겠지만 과학적으로 엄밀히 말하자면 이것은 유리전이온도 이하로 굳힌 액체라고 하는 것이 옳다. 즉, 실생활에서 자주 접하는 유리는 사실 고체가 아니다!
- 10물론 유럽 사람들이 아이오딘값이 더 높은 동유를 사용하지는 않았을 것이다. 동백나무는 동아시아에서 주로 자생하는 나무이기 때문이다.
▼[이전글] 2. 물감의 역사 (History of Paints)
▼[다음글] 4. 유화 기법의 특성 (Oil Painting Techniques)
 |
이 저작물은 크리에이티브 커먼즈 저작자표시-비영리-동일조건변경허락 4.0 국제 라이선스에 따라 이용할 수 있습니다. |