fluorF's Laboratory
웹사이트 소개
Introduction of the website
fluorF 소개
Introduction of fluorF
새로운 소식
News
하루 이야기
Daily essay
글
Articles
사진첩
Album
방명록
Guestbook
글
Articles
미술 4
Fine Art 4
유화와 화학
유화 기법의 특성
Oil Painting Techniques
사람들에게 유화의 가장 큰 특징이 무엇이냐고 물어보면 누구든지 덧칠이 가능하다는 장점을 언급할 것이다. 물감을 의도치 않은 번짐의 우려 없이 안전하게 덧칠할 수 있는 것은 유화의 가장 큰 특성 중 하나이기 때문이다. 결론부터 먼저 이야기하자면, 3편에서 이미 살펴보았듯 먼저 칠한 물감이 공기 중 산소와 반응하여 가교되면 물감을 구성하는 기름의 분자량이 급증하게 되는데 이렇게 거대해진 분자량의 고체 물질은 대체로 용매에 다시 분산되지 않기 때문에 안전한 덧칠이 가능해진다. 딱딱하게 굳었으니 잘 안 풀리는 것이 당연한 것 아닌가? 라고 생각할 수 있지만 이 사실을 주의 깊게 살펴보면 뭔가 이상한 점을 발견할 수 있다.

예를 들어 팔레트에 짜 놓은 수채화 물감을 생각해보자. 팔레트에 수채화 물감을 짜 놓으면 처음에는 약간 점성이 있는 액체라는 것을 알 수 있다. 왜냐하면 전색제(展色劑, vehicle)인 물과 아라비아 고무(gum arabic)가 다량 포함되어 있으니까. 그런데 하루 이틀 시간이 지나면 물이 모두 증발하면서 수채화 물감은 딱딱하게 굳어 버리게 된다. 물론 여기서 우리는 절망할 필요가 없다 ㅡ 붓에 물을 묻혀 딱딱하게 굳은 물감을 몇몇 쓱쓱 문지르면 물감이 풀려나오면서 채색할 수 있는 액체 상태가 되기 떄문이다.
하지만 유화 물감에서는 이런 현상을 발견할 수 없다. 유화를 그리는 화가들이 수채화 물감과는 달리 유화 물감을 팔레트에 미리 짜놓지 않고 그림을 그릴 때에만 비로소 짜내어 바로 사용하는 이유가 여기에 있다. 유화 물감을 팔레트 위에 짜놓고 장시간 두었다 치자. 그러면 가교가 진행되면서 유화 물감은 딱딱하게 굳는다. 당신은 이 물감을 다시 풀어내기 위해 아마인유를 조금 부어 붓에 묻힌 뒤 딱딱학 굳은 유화 물감 위로 쓱쓱 문질러댄다. 어랍쇼? 물감이 안 풀린다?
1편에서 언급했지만 용매와 분산매가 용질 혹은 분산질을 고르게 퍼뜨릴 수 있는 이유는 용매-용질 혹은 분산매-분산질 사이의 상호 작용에 기인한다고 설명했다. 잠깐, 문장이 불필요하게 길어지는 것을 막기 위해 용매와 용질만 언급하도록 하겠다. (즉 용매라는 것은 용매와 분산매, 용질이라는 것은 용질과 분산질을 모두 아울러서 표현하도록 하겠다는 뜻이다.) 우리가 살펴봤던 것은 용매-용질의 상호 작용이 용매끼리 혹은 용질끼리의 상호 작용보다 우수할 경우 용질은 기꺼이 용매에 퍼져나가길 선호할 것이라는 점이었다.
이제 건조된 물감에 아마인유를 들이붓는 과정을 화학적으로 살펴보자. 건조된 물감은 비록 가교되어 있지만 구성 성분은 아마인유와 하등 다를 것이 없고, 단지 아마인유 분자들이 이써(ether) 결합으로 모두 촘촘히 연결되어 있을 뿐이었다. 따라서 아마인유-아마인유의 화학적 상호 작용과 가교된 아마인유-아마인유 사이의 화학적 상호 작용 사이에는 별반 차이가 없다. 아마인유는 아마인유와 동일한 물질이기 때문에 잘 섞이는 것이 당연하다. 그러므로 고찰이 여기에 이르면 가교된 아마인유 역시 아마인유에 잘 섞여야 마땅한데... 실제로는 그렇지 않다! 완벽히 건조된 물감은 아마인유에 잘 풀려나오지 않는다는 것이 문제다.
이 모순적인 상황의 해답은 1편의 각주 5번에 있었다. 어떤 혼합 반응이 자발적(spontaneous)인지 아닌지는 용매와 용질 간의 화학적 상호 작용, 곧 엔탈피(enthalpy, ΔH)로만 결정되는 것이 아니며, 사실 이는 깁스 자유 에너지(Gibbs free energy, ΔG) 측면에서 이해하는 것이 옳다. 열역학(熱力學, thermodynamics)에서는 깁스 자유 에너지가 음수(ΔG<0)일 때 해당 화학 반응이 자발적이라고 이해하는데, 이 때문에 어떤 혼합 반응이 열을 외부로 방사하는 발열 반응(ΔH<0)인 경우 대체로 자발적인 반응일 것이라고 예측하게 되는 것이다. 하지만 엄밀하게 이야기하면 모든 발열 반응이라고 해서 깁스 자유 에너지가 음수인 것은 아니다. 깁스 자유 에너지는 ΔG = ΔH - TΔS 으로 표현되는데, 여기서 엔탈피 외에 이상한 항이 하나 더 포함되어 있는 것을 알 수 있다. T는 온도를 의미하고 ΔS는 저 유명한 엔트로피(entropy)를 말한다.
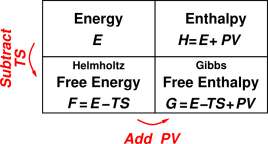
깁스 자유 에너지 측면에서 아마인유의 혼합을 설명 해보자. 아마인유와 아마인유는 왜 섞일 수 있는 것일까? 이건 마치 왼손에 든 물컵의 물과 오른손에 든 물컵의 물은 어떻게 섞일 수 있는지 묻는 무식한(?) 질문일 수 있지만 나름 의미가 있는 질문이다. 우선 왼쪽의 아마인유를 아마인유1이라고 하고 오른쪽의 아마인유를 아마인유2라고 하자. 아마인유1끼리의 상호 작용과 아마인유2끼리의 상호 작용은 아마인유1과 2 사이의 상호 작용과 정확히 동일하다. 왜냐하면 둘 다 똑같은 아마인유니까 말이다. 따라서 아마인유1과 2가 섞인다고 해서 전체 계의 상호 작용 차이는 일어나지 않게 된다. 열역학적으로 표현하면 아마인유1과 2의 혼합 과정에서 발생하는 엔탈피 변화는 없다(ΔH=0).
그런데 엔트로피 문제가 끼어든다. 아마인유1과 2가 섞이게 되면 전체 계의 입자 개수가 폭증하게 된다. 독일의 유명한 물리학자인 루트비히 볼츠만(Ludwig Boltzmann)은 통계역학적인 처리를 통해 엔트로피의 절대적 값을 정의할 수 있음을 보였는데 그 식은 S = kBln W 이다. 여기서 W는 해당 계에서 가능한 모든 미시적 상태(microstate)의 수인데 쉽게 생각한다면 입자의 개수가 커질수록 미시적 상태가 급증하는 것은 당연한 이치이다. 마치 레고 블록 여남은 개를 어질러 놓은 상황과 수백 개를 어질러 놓은 상황이 있다고 할 때 어느 쪽에서 더 큰 스트레스를 받겠는가? 당연히 엔트로피가 높은 후자일 것이다. 이처럼 동일한 두 물질을 혼합할 때에는 엔트로피가 급증하므로(ΔS>0) 결과적으로 깁스 자유 에너지는 음수(ΔG<0)가 되고, 이로 인해 동일한 두 물질의 혼합 과정은 자발적인 반응이 된다.
자, 이제 가교된 아마인유와 액체 상태인 아마인유를 혼합할 때를 생각해 보자. 가교된 아마인유와 액체 아마인유 역시 동일한 아마인유이므로 이 과정에서도 엔탈피 변화는 거의 무시할 정도로 없다고 봐도 무방하다(ΔH~0). 그래서 엔트로피쪽으로 건너가서 살펴보는데, 여기서 다른 점이 발생한다. 가교된 아마인유는 거대하게 연결된 하나의 집단 네트워크이며 상온이 유리전이온도(琉璃轉移溫道, glass transition temperature)보다 낮은 온도이므로 유동성이 전혀 없는 상태이다. 따라서 가교된 아마인유는 아무리 주변에서 액체 아마인유들이 같이 놀자도 꾀어대도 꿈쩍도 안하고 있을 공산이 크다. 따라서 액체 아마인유 분자들은 가교된 아마인유가 있으나 없으나 미시적 상태의 개수가 크게 변화하지 않는다. 따라서 엔트로피 변화는 이전 경우보다 급격하게 감소하게 되고 이 경우에는 거의 0에 가까운 수준일 것이다(ΔS~0). 그 결과 깁스 자유 에너지 변화는 거의 0에 가깝게 될텐데 이는 평형(equilibrium) 상태임을 의미하며 자발적으로 혼합이 일어나지 않음을 암시한다.1
따라서 유화에서는 마른 물감 위에 다른 물감을 안전하게 덧칠할 수 있는 것이다. 여기서 중요한 것은 먼저 칠한 물감이 완전하게 건조되어야만 다른 물감이 덧칠될 수 있다는 것이다. 만일 건조 상태가 완벽하지 않다면 덧칠한 물감이 아래 칠해진 물감과 섞이게 될 것이고 이것은 의도한 것과 전혀 다른 결과를 내게 된다. 물론 저명한 화가들은 마르지 않은 물감 위에 다른 물감을 덧칠하는 것을 하나의 또다른 기법(!)으로 활용하여 다양한 표현을 구사해내는 데 성공했는데 이것이 소위 웻온웻(wet-on-wet) 혹은 알라 프리마(alla prima) 기법이다.

유화에는 다양한 기법이 있지만 나를 굉장히 흥미롭게 만들었던 기법은 바로 글레이징(glazing)이라는, 즉 그림 표면에 광택(光澤, gloss)이 나는 듯한 효과를 주면서 보다 깊이 있는 색깔을 구현하는 기법이었다. 이러한 기법은 수채화에서는 전혀 들어본 적 없는 독특한 표현 방식이었기에 굉장히 신기하게 느껴졌다. 글레이징 기법은 이미 건조된 물감층 위에 투명한 물감층을 덧바르는 방식으로 진행되는데, 왜 투명한 물감층을 바르는 것이 광택과 연결되는 지에 대해 이해하려면 광학(光學) 지식이 조금 필요하다. 빛이 어떤 물질에 도달하게 되면 다음과 같은 현상이 일어나게 된다.
- 어떤 빛은 그 물질의 에너지 준위 차이에 딱 맞아 떨어져 흡수된다. 이를 흡광(吸光, absorption)이라고 한다.
- 어떤 빛은 거울에 반사되듯이 입사각과 완전히 같은 반사각으로 반사된다. 이를 정반사(正反射, specular reflection)라고 한다.
- 어떤 빛은 물질 표면에서 반사되는데 입사각과는 전혀 무관하게 반사되어 마치 산란되는 것처럼 느껴진다. 이를 난반사(亂反射, diffuse reflection)라고 한다.
- 어떤 빛은 위에서 언급한 현상과 무관하게 물질을 그대로 통과해버린다. 이를 투과(透過, transmission)라고 한다.
- 1그런데 평형이라고 해서 양쪽 상황이 빠르게 왔다갔다하는 평형을 상상해서는 곤란하다. 깁스 자유 에너지는 반응의 자발성/비자발성만을 예측할 뿐 해당 반응의 빠르기, 즉 속도론(kinetics)에 대해서는 아무 말을 하지 않기 때문이다. 가교된 아마인유와 아마인유의 유동성을 고려해보면 해당 평형은 굉장히 느린 반응 속도를 기반으로 한 평형임을 예상할 수 있다. 따라서 건조된 물감이 풀려나갈 걱정 따위는 하지 않아도 좋다!
- 2https://www.louissmithart.com/portrait-workshops/glazing-steps-web/
- 3https://www.ch.ic.ac.uk/local/projects/steer/chloro.htm
- 4엄밀하게 이야기하면 유전체(誘電體, dielectric)의 경우 물질 입자들의 분극(分極, polarization)이 요동치게 되는 것이고, 금속의 경우에는 전자 분포 자체가 요동치게 된다.
- 5니스는 영어로 바니시(Varnish)라고 불리는 투명한 도료인데 일본에서 이를 와니스(ワニス)라고 부르는 바람에 우리 나라에는 '니스'라는 국적불명의 용어로 불리게 되었다.
- 6Meints, T.; Teischinger, A.; Stingl R.; Hansmann, C. European Journal of Wood and Wood Products. 2017, 75 (4), 499-509.
- 7물질의 흡수 능력은 소위 흡광 계수(extinction coefficient)로 나타내는데 저 유명한 베르-람베르트 법칙(Beer-Lambert Law)에 의해 정의된다.
- 8https://mattharveyart.com/2017/11/28/portrait-painting-step-by-step-glazing-over-grisaille/
언뜻 보면 굉장히 간단한 것 같은데 이게 생각보다 만만치 않은 주제이다. 1번 흡광의 경우 이는 빛과 물질을 구성하는 물질 전자 구조와의 상호 작용이다. 예를 들어 어떤 물질이 빨간색 빛을 주로 흡수한다고 하면, 이 물질이 방사하는 빛에는 빨간색 빛이 빠져있을 것이다. 그 결과 우리 눈에는 이 물질이 빨간색의 보색인 초록색 계열로 보일 것이다. 대표적인 물질이 바로 나뭇잎인데 나뭇잎에 풍부하게 들어있는 색소인 엽록소 a는 태양 에너지를 최대한 흡수하기 위해 주로 빨간색 계열의 빛을 흡수한다. 이에 따라 엽록소 a의 색깔은 초록색으로 인지된다.

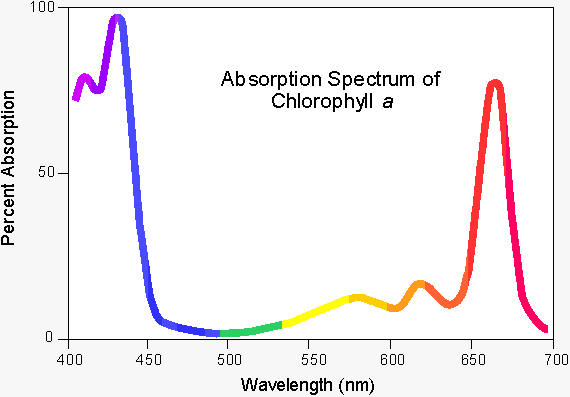
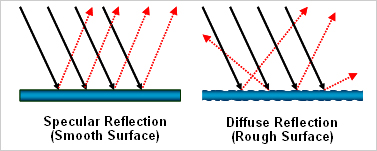
그런데 이 과정은 2,3번의 반사(反射, reflection)와 전혀 다른 이야기이다. 반사란 무엇인가? 손가락 두 개 꼰다고 반사가 되는 것은 아니다! 빛은 전자기파의 일종이므로 빛이 형성하는 전자기장은 물질의 구성 성분인 전자와 상호 작용할 수 있는데, 만약 빛이 어떤 물질 표면에 입사하게 되면 입사된 표면에 존재하는 물질 입자들의 전자 분포는 빛이 선사하는 전자기장으로 인해 요동치게 된다.4 전자 분포가 요동치게 되면 전자기파가 발생하게 되는데, 이 때 입사된 빛은 물질과의 상호 작용으로 인해 얻거나 잃는 것이 전혀 없었으므로 각 표면 입자들은 마치 안테나처럼 입사된 빛과 동일한 파장의 빛이 방사하게 된다. 이것이 반사의 원리이다. 즉, 반사는 흡광과는 달리 물질 에너지 구조와의 근본적 상호 작용이 없으며 서로 다른 매질의 표면에서만 발생하는 현상이다.
만일 반사면이 굉장히 매끈하고 평평하다면 수많은 전자 분포의 요동들로부터 발생하는 전자기파는 중첩의 원리(Superposition principle)에 따라 입사각과 동일한 각도로 방사되는 것으로 계산될 수 있다. 이것이 바로 2번의 정반사에 해당하며, 초등학교 때부터 입사각과 반사각이 같다고 배워 온 일종의 상식이 바로 여기에서 비롯되었다. 한편 반사면이 이상적으로 매끈하고 평평하지 않다면 수많은 전자 분포의 요동들의 방향은 제멋대로 정해질 것이고 이로 인해 반사각은 무작위적이 될 것이다. 이것이 바로 3번의 난반사에 해당하는데, 스스로 발광(發光)하지 않는 물체인 경우 ― 눈 앞에 있는 컴퓨터 마우스든 저 멀리 떨어진 달이든 ― 난반사로 인해 우리 눈이 비로소 물체를 인식할 수 있게 된다.
하지만 어떤 빛은 표면 매질과의 상호 작용 중에 물질 안으로 뚫고 들어갈 수도 있는데, 이것이 4번 투과 현상이다. 이러한 현상은 특히 빛이 매질 표면에 비스듬히 입사했을 때 더 잘 일어나는데, 투과의 가장 대표적인 예가 바로 굴절(屈折, refraction)이 되겠다. 프랑스의 물리학자 오귀스탱-장 프레넬(Augustin-Jean Fresnel)은 반사와 투과 현상을 모두 한데 묶어 명쾌하게 설명하는 수식을 전개했는데, 이를 프레넬 공식(Fresnel equation)이라고 하며 학부 기초 전자기학 및 광학 수업에서는 무조건 다루는 내용 중 하나가 되겠다.

이제 광택에 대해서 이해를 해보자. 어떤 물체가 광이 나도록 하는 방법은 크게 두 가지가 있다. 첫번째는 '광이 날 때까지' 열심히 닦는 것이다. 이것은 앞에서 언급한 정반사와 난반사로 이해 가능하다. 특히 금속의 경우가 그러한데 오래되거나 녹이 슬면 금속 표면은 굉장히 거칠게 되어 정반사가 거의 안 일어나게 된다. 그래서 연마제를 바른 뒤 열심히 문질러대면 표면이 매끈해지게 되고, 이를 통해 잃었던 광택을 되찾을 수 있게 된다.
두번째는 표면에 무언가를 칠하는 것이다! 학교 다닐 때 미술 시간에 지점토나 찰흙 공예를 해본 적이 있다면 멋지게 만든 작품을 그늘에서 적절히 건조시킨 다음에 '니스'칠을 했던 것이 혹시 기억나는지?5 니스칠을 해본 사람들은 모두 기억하겠지만 니스 뚜껑을 열면 굉장히 역한 석유 냄새가 나는데, 이는 테레빈유(turpentine)나 석유 추출액과 같은 강한 휘발성 용매에 용해된 상태로 판매되기 때문이다. 그렇다면 도대체 니스에는 무엇이 녹아있길래? 놀랍게도 니스의 주원료는 전편에서 살펴본 건성유(乾性油, drying oil) 혹은 각종 수지(樹脂, resin)이다. 그리고 이들 구성 성분의 보편적인 특징은 이중 결합을 포함하고 있다는 것이다.

그렇다면 굳이 더 길게 설명을 하지 않아도 이전 내용을 기억하고 있는 많은 독자들은 니스칠의 원리를 대강 이해할 수 있을 것이다. 우선 휘발성 용매에 묽게 녹아 있는 니스를 나무 위에 칠한다. 용매는 빠른 시간 안에 날아가고 용질이었던 건성유 혹은 수지만이 물체 표면에 남게 되는데 아직은 가교가 진행되지 않아 경화가 덜 되었기 때문에 아직은 끈적거리는 상황이다. 그래서 니스칠을 하고 나서 하룻동안은 다른 물체와 절대로 접촉해서는 안 되는 것이었다. 시간이 지나면서 공기 중 산소가 니스 성분들을 가교시키고 경화가 완벽하게 진행되면 물체 표면에는 투명하고 얇은 고체막이 형성된다. 여기까지는 무리가 없다. 다만 우리가 주목하고 싶은 것은, 바로 이 가교된 니스 고체막 덕분에 물체에서 광택이 난다는 것이다.
그런데 잠깐만, 우리는 광택이 난다는 게 무슨 의미인지 알고 있나? 번쩍번쩍 광이 난다는 표현을 수시로 쓰고 있지만, 정작 '광이 나는게 뭔데?' 라고 물어보면 뭐라 답하기가 애매해진다. 하지만 광택이 나게 하는 첫번째 방법을 상기해본다면 답은 간단하다. 어떻게 한다고 했더라? 바로 '광이 날 때까지' 열심히 닦아 정반사를 일으키게 한다고 했다. 즉, 광택의 근원은 바로 정반사이다. 물체 표면에서 정반사가 일어나는 물질을 관찰할 때 우리는 '광이 난다'라고 표현 가능하다. 예를 들면 새로 주조한 동전의 매끈한 표면에서 정반사 되어 눈에 확 들어오는 흰 빛을 보고 우리는 광택이 난다고 말할 수 있는 것이다. 자, 그렇다면 이제 니스칠을 하면 광택이 난다는 말을 이제 과학적으로 바꿔 보면 무슨 말이 될까? 바로 니스칠을 하면 난반사를 일으키던 물질 표면이 정반사를 일으킨다는 것이다. 아니 어떻게? 이 니스칠을 좀 더 복잡하게 일컫자면, 이는 기존 물체 표면에 투명한 가교 고분자층을 도포하는 것이다. 이를 그림으로 표현하면 아래와 같다. 왼쪽은 캔버스 위에 단순히 물감이 칠해진 것이고, 오른쪽은 그 물감 위에 가교 고분자층이 얹어져 있는 것이다. 그리고 검은색 화살표는 캔버스 표면으로 입사하는 빛을 표현한다.
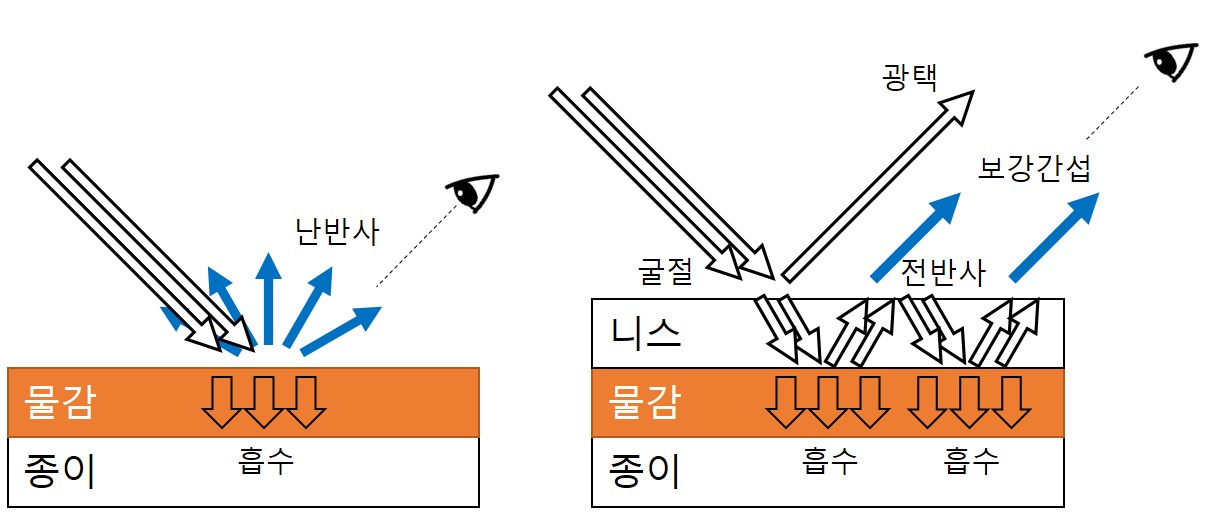
우선 왼쪽의 경우를 살펴보자. 물감 표면에 입사된 빛은 흡수되거나 반사되거나 투과하게 된다. 그런데 물감으로 쓰이는 안료는 대체로 빛을 흡수하는 능력이 아주 탁월한 물질들이다.7 따라서 대부분의 빛은 안료에 의해 흡수되고, 흡수되지 않은 빛은 안료로부터 반사되어 우리 눈에 들어오게 된다. 이 때 안료는 물감 내에서 굉장히 불규칙적으로 존재하기 때문에 빛은 난반사되며 어느 각도에서나 작품을 바라봐도 물감의 색깔을 음미(?)할 수 있다.
이제 오른쪽의 경우를 살펴보자. 먼저 빛은 니스층에 입사된다. 그런데 니스는 엄연히 고분자이고 이 고분자층의 굴절률(refractive index)은 공기보다 높기 때문에 비스듬하게 입사된 빛은 더 꺾여서 니스층을 통과하게 된다. 이를 빛의 굴절이라고 한다. 굴절된 빛은 이제 니스층을 통과해 바닥에 있는 물감 표면에 닿게 되고, 앞서 이야기한 것처럼 물감의 안료는 대부분의 빛을 흡수하기에 흡수되지 않은 빛은 안료로부터 난반사된다. 그리고 난반사는 그야말로 무작위적인 각도로 빛을 반사하기 때문에 오만가지 방향을 가지는 난반사광이 안료표면으로부터 발생된다. 그런데 앞의 경우와 다른 점은 이렇게 난반사된 빛이 눈에 도달하기 전에 그 위에 덮여 있는 니스층을 통과해야 한다는 것이다.
니스층에서 공기 중으로 빛이 빠져나오려고 하면 아까와는 반대의 방향으로 굴절이 일어나야 한다. 그런데 빛이 굴절률이 높은 매질로부터 낮은 매질로 진행할 때 특정 임계 각 이상으로 입사되는 각은 표면에서 모두 반사되어 버리는데 이를 우리는 전반사(全反射, total reflection)라고 한다. 이렇게 전반사된 빛은 다시 안료로 돌진하게 되고 거기서 난반사가 일어난다. 또 일부는 전반사가 되어 다시 안료로, 그리고 난반사가, 또 전반사가, 난반사가... 그 결과 상당한 양의 빛은 전반사가 일어나지 않는 작은 입사각으로 니스층을 빠져나오게 된다. 이렇게 눈으로 들어오는 빛은 소위 보강 간섭(constructive inteference)이 일어난 빛으로서, 물감 표면을 바라봤을 때 눈을 통해 들어오는 색깔을 띤 빛의 세기가 니스칠을 하지 않았을 때보다 훨씬 큼을 의미한다. 그래서 투명한 니스칠을 했을 뿐인데도 니스층 아래에 있는 표면의 색깔이 훨씬 더 두드러져 보이는(=채도가 높아져 보이는) 효과가 생긴다. 실제로 초등학교 때 찰흙으로 소조 작품을 만들고 표면에 니스칠을 한 경험이 있다면 찰흙 색깔이 더 진해져 보이는 것을 알 수 있는데 그 이유가 바로 여기에 있다.
그런데 효과는 이뿐만이 아니다. 앞에서 언급했듯 빛 일부는 니스층 표면에서 정반사된다. 그렇게되면 아래층에서 방향성 있게 뿜어져 나오는 빛에 더하여 광택의 효과가 더해지게 된다. 즉 캔버스 위에 단순히 칠해진 물감과는 달리 더 선명하고 윤기 나는 색깔의 표현이 가능해지는 것이다. 이를 글레이징이라고 한다. 유화에서 그림 위에 니스칠을 할리는 당연히 없고, 이러한 글레이징 효과를 위해서 대개 유화의 전색제 역할을 하는 아마인유나 특수한 목적으로 다양하게 개발된 글레이징 매제(媒劑)를 덧칠하게 된다.
하지만 글레이징 효과는 여기서 끝이 아니다. 유화의 전색제나 매제를 칠한다면 거기에 약간의 안료를 풀어서 칠할 수도 있는 것 아닌가? 사실상 글레이징 채색 기법의 본질은 여기에 있다. 이것은 앞에서 언급한 덧칠의 확장판이라고 할 수 있는데, 앞의 덧칠은 다른 색깔의 안료로 하부 안료층을 완전히 덮어버리는 것이지만, 글레이징에서는 투명한 안료층을 덮음으로써 광택과 하부 안료층의 색깔을 선명하게 함과 동시에 투명한 안료층 고유의 색까지 같이 곁들이게 함으로써 색 혼합의 효과까지도 거두게 된다. 그리고 이렇게 겹쳐진 색깔은 소위 가산 혼합(additive color mixture)에 의해 명도가 높아진, 즉 밝은 느낌의 색깔을 띠게 된다.
이와 같은 기법은 다른 물감으로는 도저히 표현하기 힘든 성질의 것이지만, 사물로부터 인체의 눈으로 들어오는 빛에서 일어나는 다양한 광학적 현상이 제대로 모사될 수 있기 때문에 유화로 그려진 사물은 다른 물감을 통해 그려진 것보다 훨씬 사실감 있게 그려질 수 있다. 이로 인해 서양화의 정물화 및 풍경화는 동양화의 그것에 비해 사람이 인식하는 바를 굉장히 비슷하게 모사할 수 있었다.
임파스토(impasto)는 이탈리아어로 반죽을 의미하며, 이 기법은 물감을 캔버스 위에 두텁게 바름으로서 양감과 질감을 표현하는 것이다. 물감을 찍을 때 붓을 쓰지 않고 나이프나 심지어 손을 쓰는 경우도 있다고 하는데, 이를 통해 붓으로는 표현이 되지 않는 세심한 질감의 표현이 가능하다고 알려져 있다. 임파스토 기법의 구현이 가능한 물감은 유화 말고도 아크릴 물감이 있는데, 이는 임파스토 기법의 화학적 원리가 물감의 전색제를 구성하는 고분자와 관련이 있다는 것을 의미하며, 사실 원리는 덧칠의 원리와 동일하다.
앞의 논의를 간단히 다시 떠올려보자면, 캔버스 위에 발린 아마인유는 시간이 지나면서 건조 과정을 거쳐 가교되어 고착되는데, 이 때 고착된 아마인유는 가교가 진행되던 도중의 물리적 형태 그대로이다. 왜냐하면 가교되는 아마인유의 유리전이온도는 어느 순간부터 상온을 넘어가기 때문에 그 순간부터는 유동성이 전혀 없는 상태이다. 즉, 가열 혹은 외력의 인가라는 특수한 상황이 발생하지 않는이상 가교된 아마인유 네트워크는 물리적으로 변형되지 않는다. 그러므로 물감이 발린 형태 그대로를 유지하는 것이다.
제대로 된 효과를 내기 위해서는 물감이 적절하게 가교되기 전까지 그 형태를 유지할 수 있을 만큼의 점도를 가진 물감을 적절하게 캔버스 위에 바르는 기교가 필요하다. 너무 묽어서는 안되지만, 진하다고 해서 작가가 의도하는 질감을 다 표현할 수 있는 것은 아니다. 이러한 임파스토 기법을 적극적으로 활용한 화가 중 가장 유명한 사람은 아무래도 빈센트 반 고흐(Vincent van Gogh)일 것이다.

▼[이전글] 3. 기름 화학 (Oil Chemistry)
▼[다음글] 5. 파란색의 발견 (Discovery of Blue Color)
 |
이 저작물은 크리에이티브 커먼즈 저작자표시-비영리-동일조건변경허락 4.0 국제 라이선스에 따라 이용할 수 있습니다. |